Opinión: Sergio Marshall
Actualización 11 de Mayo
¿Qué se hace mientras esperamos la vacuna?
Actualmente, solo hay atención de apoyo disponible para los pacientes críticos con COVID-19, quienes se beneficiarían enormemente de la disponibilidad de enfoques terapéuticos directos. Para ello, mientras esperamos la vacuna salvadora, hay que buscar alternativas para el creciente número de pacientes que se hacen sintomáticos, empeoran y algunos de ellos mueren. Recordemos entonces que la vacuna no sirve para los enfermos declarados, pues una vacuna eficiente es, por definición y por principio, protectora, es decir, requerida para prevenir la infección.
¿Cómo entonces ayudar a los enfermos declarados y en un futuro cercano a los portadores asintomáticos del virus que pueden en cualquier momento declarar la enfermedad, con las preocupantes y a veces trágicas consecuencias finales?
Un enfoque para identificar la medida terapéutica a aplicar es la reutilización de medicamentos aprobados y desarrollados para otras enfermedades virales, sacando partido de la información detallada existente sobre farmacología y toxicología humana, lo que permitiría efectuar ensayos clínicos rápidos y una revisión reguladora. Estos medicamentos, ya conocidos y otros por descubrir, caen en la categoría de Antivirales.
Los antivirales son compuestos capaces de inhibir una o varias etapas del ciclo de multiplicación viral dentro de la célula huésped. En la práctica, su aplicación debe hacerse a concentraciones no tóxicas para el huésped. Sin embargo, el desarrollo de este tipo de drogas se encuentra muy obstaculizado por la dificultad que presenta el virus al utilizar toda la maquinaria de la célula hospedera para su replicación y expresión. La clave entonces para una quimioterapia exitosa con un determinado antiviral, es lograr la inhibición de una o más de las etapas de expresión del virus, sin afectar el funcionamiento de la célula huésped y así minimizar la aparición de efectos adversos.
Para comprender el mecanismo de acción de los antivirales, es necesario considerar el ciclo vital completo de un virus típico, que puede ser desglosado en 5 pasos o etapas:
1. Adhesión.
2. Penetración. Pérdida del revestimiento.
3. Duplicación del genoma viral. Duplicación de las proteínas virales.
4. Ensamblaje de la nueva progenie viral.
5. Liberación.
La clasificación de los antivirales conocidos y aprobados por instancias competentes internacionales (FDA en USA) se hace en base a su mecanismo de acción o su perfil de actividad y cómo interfieren en las distintas etapas de la replicación viral. Aquí doy algunos ejemplos, de una gran gama existente:
Análogos de los ácidos nucleicos: zidovudina, ganciclovir, vidaravina, aciclovir.
Inhibidores de RNA virales: ribavirina, lamivudina.
Bloqueadores de la adhesión y penetración: amantadina, oseltamivir.
Inhibidores de la síntesis proteica: interferones.
Alteración de la fase de maduración proteica de los virus : inhibidores de proteasas virales.
TRATAMIENTOS PARA CORONAVIRUS SARS Y MERS, ANTES DEL SARS-CoV-2
La ribavirina sola o en combinación con otros antivirales ha sido el tratamiento más frecuentemente estudiado. En la epidemia SARS (2003), los beneficios reportados de la ribavirina sobre la mortalidad fueron inconsistentes (5% - 42.8%), pero fueron más homogéneos en la mejoría de los síntomas (71.4%-80%) y en la disminución en la admisión a UCI (13%-20%).
El mayor problema de la ribavirina fue la alta incidencia de eventos adversos, especialmente hemólisis (reportado en el 68.5% de los pacientes). Ahora, cuando se combinaron ribavirina con lopinavir/ritonavir, la reducción en la mortalidad fue ligeramente mayor. Los estudios que evaluaron el uso de interferón sólo contra medidas de soporte, mostraron una mejoría clínica de los pacientes, sin embargo, cuando se comparó interferón y ribavirina, no se encontraron diferencias significativas, pero sí se detectó una leve reducción de la mortalidad.
La efectividad de la ribavirina en la reducción de mortalidad por SARS y MERS mejoró cuando el tratamiento fue hecho tempranamente, en las primeras 48 horas de los síntomas, y cuando se pudo tener un monitoreo cuidadoso de los pacientes, para actuar rápidamente en caso de efectos adversos. En resumen, el uso de este antiviral no es considerado promisorio para tratar el COVID-19.
AVANCES RECIENTES CON ANTIVIRALES : ¿LA LUZ AL FINAL DEL TÚNEL?
De todas las terapias experimentales que se están realizando hoy en día, DOS antivirales han dado resultados prometedores que ha llevado a su aprobación temporal para su evaluación clínica por el FDA americano:
La Ivermectina, un antiparasitario aprobado por la FDA que previamente mostró tener una actividad antiviral de amplio espectro in vitro, ha resultado inhibir a SARS-CoV-2, con una sola dosis en células susceptibles al virus en cultivo, resultando en una reducción de aproximadamente 5000 el número de copias del ARN viral a las 48 horas post-adición. La ivermectina, por lo tanto, requiere de una mayor investigación para posibles beneficios en humanos, por lo que deberá ser evaluado detenidamente para una eventual acción equivalente in vivo, sin toxicidad.
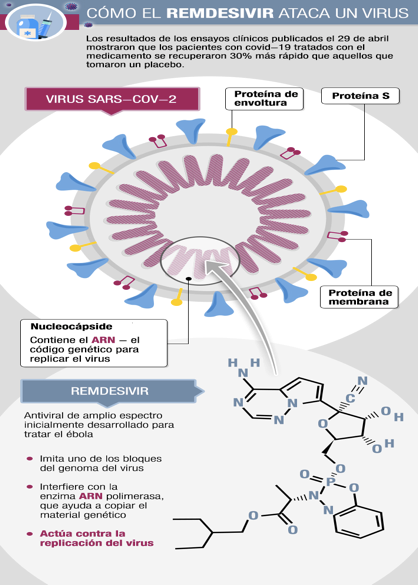
El Remdesivir, el más prometedor de los dos, es un análogo de nucleótidos y por lo tanto inhibe a la polimerasa viral evitando que el virus de multiplique en las células infectadas.
El Remdesivir, desarrollado originalmente para combatir el Ébola por la compañía farmacéutica Gilead Sciences, en el estado de California Estados Unidos, se comprobó que ayudaba a acortar el tratamiento de pacientes críticos afectados con COVID-19 (acortamiento en promedio de 5 días de los tiempos en UCI y UTI con una disminución de casi un 4% en los promedios de muertes de los pacientes tratados).
Ante ello, la compañía donó 1,5 millones de unidades de la droga, equivalentes a 200 mil tratamientos, dependiendo de cuánto tiempo se administre en los pacientes para realizar ensayos iniciales que involucraron a 1.063 personas en hospitales de todo el mundo, incluidos Estados Unidos, Francia, Italia, Reino Unido, China y Corea del Sur.
Algunos pacientes recibieron el medicamento y otros recibieron un placebo. Ante el prometedor resultado antes mencionado, la Administración de Medicamentos y Alimentos de EE.UU. (FDA) autorizó su uso en caso de emergencias, que no es lo mismo que la aprobación formal, proceso que requiere un mayor nivel de revisión y por ende su eventual ingreso al mercado global es aún indeterminado.
Hay que destacar que el estudio de este antiviral no es nuevo, Remdesivir es el resultado de más de una década de investigación, experimentación e iteración por parte de científicos de Gilead.
En los últimos años, se ha estudiado su impacto en los virus de la fiebre hemorrágica como el virus del Ébola, Marburg y Nipah, así como en otros coronavirus como el SARS y el MERS, acumulando suficiente conocimiento para que cuando surgiera un nuevo virus, como lo ha hecho el SARS-CoV-2, se pudiese avanzar muy rápidamente en los ensayos clínicos, lo que afortunadamente así ha sucedido.
A pesar de lo esperanzador que representa este antiviral, hay que dejar en claro que Remdesivir no es una cura para el virus, pero su aplicación en pacientes críticos es una valiosa ayuda al acortar la estadía de los pacientes en la UCI y baja la tasa de mortalidad. La Compañía Gilead ha indicado que dispondrá de a lo menos 140.000 nuevas dosis para fines de Mayo y de un millón de dosis adicionales para fines de este año.
La figura adjunta muestra el blanco del Remdesidir, así como los eventuales blancos para otros potenciales antivirales.
Algunas referencias:
1. R. K. Guy et al., Science 10.1126/science.abb9332 (2020).
2. Caly L et al. (2020).The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. https://doi.org/10.1016/j.antiviral.2020.1047
